通过[5+2+1]反应和跨环Epoxide-Alkene环化实现对Isohirsut-4-ene六步全合成
原标题:通过[5+2+1]反应和跨环Epoxide-Alkene环化实现对Isohirsut-4-ene六步全合成
导语
三奎烷类(特别是线型三奎烷类)天然产物具有重要的生物活性,对这些分子和其类似物的合成可以为进一步的生化与药物研究提供支持。另外,三奎烷类天然产物中紧凑的并环结构与多样的取代模式也促使有机化学家们开发更多的新反应和合成策略。近日,北京大学余志祥教授课题组以[5+2+1]环加成反应、Corey-Chaykovsky反应及epoxide-alkene环化反应为关键反应实现了线型三奎烷类天然产物isohirsut-4-ene的首次6步全合成。相关研究成果发表于Org. Lett. 2022, 24, 1444–1447。
余志祥教授课题组简介
北京大学余志祥教授课题组致力于利用计算化学和有机合成在以下四个方面开展研究工作:1、发展理论和理解反应机理;2、开发新的反应和催化剂;3、合成天然产物和药物分子;4、开发新药和研究化学生物学。
余志祥教授简介
余志祥,北京大学化学学院教授。1987-1991,武汉大学,学士;1994-1997,北京大学,硕士;1997-2001,香港科技大学,博士;2001-2004,加州大学洛杉矶分校,博士后;2004-2008,北京大学,副教授,博导,理论和合成有机化学学术带头人,独立课题研究组组长;2008-现在,北京大学,教授,博导,理论和合成有机化学学术带头人。
余志祥教授主要从事于将理论计算和有机合成相结合来研究有机化学反应机理,发展有机合成方法,并将发展的有机合成方法应用于天然产物与药物分子的合成。目前已对Lu-[3+2]环加成反应、金属催化环加成反应、卡宾的插入反应等几十种重要化学反应的机理进行研究;从理论和实验上发现和验证了[1,2]-质子迁移过程需要水和其它质子给体作为催化剂的重要现象;提出一种新的半定量的前线分子轨道方法来计算反应的活化能以及分子的亲核性和亲电性;发展了合成不同环系的[3+2]、[5+1]、[3+2+1]、[5+2]、[4+2+1]、[3+3+1]、[7+1]、[5+2+1]等成环反应并将其中的一些反应用于多个天然产物的合成。另外,余志祥教授也对利用课题组所发展成环反应来合成和发现新的先导化合物和药物分子以及相关化学生物学研究充满兴趣。
余志祥教授近年获得的主要荣誉有:1.药明康德生命化学研究奖-学者奖,2018;2.北京大学拜尔研究者奖,2018;3.教育部长江学者,2015;4.全国百篇优秀博士论文指导导师,2012;5.中国化学会-SciFinder有机合成创造奖,2011;6.中国化学会-巴斯夫公司青年知识创新奖,2011;7.中国化学会-物理有机化学奖,2011;8.国家杰出青年基金获得者,2008。
前沿科研成果
通过[5+2+1]反应和跨环Epoxide-Alkene环化实现对Isohirsut-4-ene的六步全合成
三奎烷类天然产物广泛分布于植物、海洋生物与微生物中,根据三个五元环的并环方式一般分为线型,角型与螺旋浆型(图1)。自上世纪起,三奎烷类化合物就成为合成化学家们的目标分子,一个重要原因是大部分三奎烷类天然产物特别是线型三奎烷类天然产物具有重要的生物活性和潜在的生物医药价值,另一个重要原因就是三奎烷化合物紧凑的骨架结构和多样的取代模式不断地吸引着合成化学家们开发新的反应与策略。
2014年日本北里大学的Ikeda与其合作者分别从改良菌株S.clavuligerus ATGC 27064和S.clatacystinaeus OM-6519的次级代谢产物中分离得到isohirsut-1-ene和isohirsut-4-ene,但这两个天然产物的相对立体构型还没有最终确证。
天然产物全合成是确定天然产物结构的手段之一。余志祥课题组希望能够通过全合成的方式来确定上述天然产物结构,同时该全合成也将为后续的药物化学和化学生物学研究提供充足的测试原料。基于这些考虑,余志祥课题组使用本组发展的Rh催化的[5+2+1]环加成反应合成5/8并环,再结合分子内关环反应来合成isohirsut-4-ene分子。
图1. 三奎烷类天然产物(来源:Org. Lett.)
余志祥课题组前期开发了基于[5+2+1]环加成反应与跨环反应构建线型三奎烷类天然产物的策略(图2)。例如,他们通过[5+2+1]环加成反应联合aldol反应的策略实现了C-3位具有季碳的线型5/5/5三奎烷类天然产物hirsutene、hirsutic acid C和1-desoxyhypnophilin的全合成或形式全合成。另外,他们还通过[5+2+1]环加成反应联合跨环ene反应的策略来构建5/5/5和6/5/5三环骨架结构。不过遗憾的是,这两种策略均不适用于合成isohirsut-4-ene分子,因为该分子在C7位有取代基,而前期合成的分子是在C3位上有取代基(见图1)。
(来源:Org. Lett.)
图2. 基于[5+2+1]环加成反应与跨环反应的策略用于构建线型三奎烷类天然产物的研究和对天然产物isohirsut-4-ene的逆合成分析
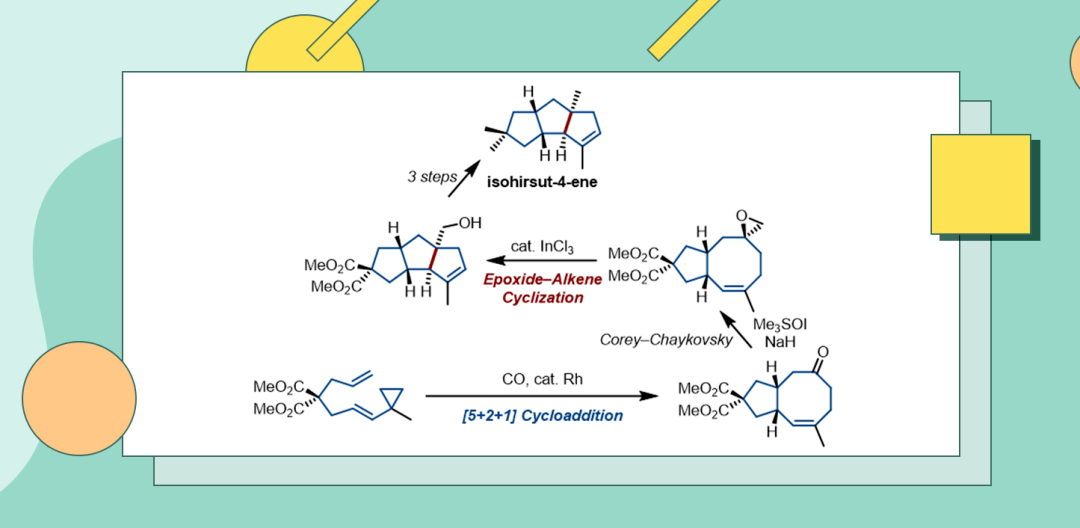
因此,他们设想使用[5+2+1]环加成得到5/8并环骨架,再利用Corey-Chaykovsky反应得到环氧化合物(图2c),随后,该环氧化合物在路易斯酸的催化下会发生类似ene反应或者Prins反应的epoxide-alkene环化反应,此方法可以在三奎烷骨架相应的C-7位引入-CH2OH基团,然后可以通过后续全局(global)脱氧反应将其转化为甲基。在此合成策略中,使用偕二酯基碳桥代替天然产物本身具有的偕二甲基碳桥主要是为了使合成中所用的原料和中间产物的沸点相应提高,有利于它们的纯化与分离。偕二酯基最后可以通过还原与脱氧过程转化为偕二甲基,从而最终得到isohirsut-4-ene这个目标分子。
参照已知合成路径,作者通过一步反应克级规模地合成文献中已报道的化合物2(图3)。化合物2可进行5 mmol规模的[5+2+1]反应,以64%的收率得到单一非对映异构体的5/8双环产物3。中间产物3在Corey-Chaykovsky环氧化反应的条件下,以45%的收率得到环氧化物4。路易斯酸催化的分子内epoxide-alkene环化反应常用于链状底物构建六元环,而跨环环化反应鲜有报道。在本项工作中,作者使用InCl3作为催化剂,可以以78%的收率将5/8并环转化为5/5/5三环化合物5。化合物4和5的相对构型由它们相应的衍生物的单晶结构确定。化合物5经过LiAlH4即LAH还原以71%的产率得到三醇产物6。由于伯醇难以通过自由基过程进行脱氧,因此作者尝试使用金属氢化物对醇的活性衍生物进行亲核脱氧反应。作者首先尝试使用MsCl和吡啶体系将三醇6转化为甲磺酸酯,再用LAH 处理。但实验结果表明LAH会进攻硫原子重新得到三醇化合物6。作者再次尝试将三醇6转化为离去性更强的三氟甲磺酸酯,再使用LAH进行亲核反应,此时底物中的三个羟基均被脱除,两步反应以32%的总收率获得目标化合物1。化合物1的NMR光谱数据与文献报道中的完全一致,从而作者通过6步全合成确证了该天然产物的结构。
图3.isohirsut-4-ene全合成 (来源:Org. Lett.)
总结,作者从已知化合物2为起始物出发,通过六步反应完成了isohirsut-4-ene的首次全合成并确证该天然产物的结构。该全合成策略中包含的关键步骤包括Rh(I)-催化的[5+2+1]环加成反应,Corey-Chaykovsky环氧化反应和分子内跨环epoxide-alkene环化反应。该策略为合成在C-7位置具有取代四级碳的线型三奎烷提供了一种新策略。
上面的研究工作是由余志祥教授指导的研究生刘婧博士(中国人民大学)和周艺(北京大学)共同完成。返回搜狐,查看更多
责任编辑:
